
XXXII Congreso Nacional de la Sociedad Española de Trombosis y Hemostasia
20
El proceso de angiogénesis es complejo e implica diversos
mecanismos moleculares y celulares bien orquestados tanto a nivel
temporal como espacial mediante un refinado equilibrio entre fac-
tores proangiogénicos y antiangiogénicos
10
. Todos estos procesos
están controlados mediante señales entre las CEs y su microambien-
te, que inducen mecanismos de transducción en la CE y conducen a
programas específicos de expresión génica para asegurar una ade-
cuada respuesta angiogénica
11
. A pesar de los factores proangioge-
nicos clásicos, como son el VEGF o el bFGF, hemos identificado
otros mecanismos de regulación como los inducidos por el FT
5,12-16
.
En los últimos años, el FT ha sido el foco de atención debi-
do a su participación en eventos no-hemostáticos y patológicos
17
.
Judah Folkman, un pionero en la investigación de la angiogénesis,
fue el primero en establecer una conexión entre coagulación y
formación de vasos sanguíneos y propuso que los dos procesos
estaban íntimamente entrelazados
18
. Posteriormente, se describió
que el FT es indispensable para el desarrollo embrionario normal
y la ausencia de este conduce a una neovascularización embrio-
naria defectuosa que conlleva a la muerte del individuo
19
. Por otro
lado, se ha descrito que las células tumorales a menudo expresan
constitutivamente FT
20
. Las vías de señalización inducidas por la
expresión de FT en células tumorales se han relacionado con la
progresión tumoral mediante la inducción de genes que promueven
la angiogénesis. El papel del FT en los procesos de metástasis
parece no solo estar relacionado con los procesos de coagulación
que tienen lugar gracias a las interacciones del dominio extrace-
lular del FT, sino también mediante el dominio citoplasmático
que puede participar en señalizaciones intracelulares dando al FT
un papel de mediador en las señalizaciones de
outside-in.
Estos
procesos ocurren inicialmente mediante la proteincinasa C (PKC),
que fosforila residuos serina de la cola citoplasmática del receptor
del FT. La fosforilación del receptor inicia la cascada de señali-
zación que conduce a la activación transcripcional de diferentes
factores proangiogénicos tales como el VEGF. Además, la unión
del la
actin-binding protein-280
(ABP-280) a la cola citoplasmá-
tica del receptor del FT induce la movilización del citoesqueleto
involucrado en la migración celular y facilita la transducción de
múltiples señales involucradas en la angiogénesis tumoral. Por otro
lado, la activación de los PARs mediante el complejo FT-FVIIa,
induce a la movilización del Ca
2+
y a la transducción de señales
vía MAPK que puede inducir a la transcripción de genes críticos
para la proliferación, migración y angiogénesis21.
Finalmente, nuestro grupo ha relacionado el FT y la angiogé-
nesis aterosclerótica intraplaca
15
(Figura 2)
. Hemos descrito que
CEs de microvasos dentro del núcleo de una placa aterosclerótica
coronaria expresan altos niveles de FT, mientras que CEs situadas
en el lumen de la misma placa no lo expresan. El FT de las CEs
de microvasos es capaz de inducir señalización a través de AKT-
Raf-ERK 1/2 y ETS1 e inducir la formación de capilares por vías
independientes de la activación de PAR2
13
. Lavenburg y colabora-
dores
demostraron que Akt y ETS1 controlan diferentes aspectos
de la movilidad celular que son esenciales para la formación de
neovasos. El proceso de angiogénesis es complejo y está robus-
tamente controlado por varias vías de señalización. La familia de
factores de transcripción ETS mantienen una fuerte implicación
en procesos de angiogénesis y de desarrollo vascular
22
y controlan
procesos biológicos mediante el reconocimiento de un consenso
de purinas GGA en la región promotora de sus genes diana. ETS1
es el primer miembro de la familia ETS, se empieza a expresar
durante la embriogénesis y ha sido relacionado con la regulación
de CCL2 y otras moléculas que controlan la función celular
22
y que
están implicadas en el balance angiogénico (factores pro angio-
génicos y antiangiogénicos), entre ellos VE-Cadherina, VEGF,
angiotensina II (Ang-II) y TGF
β
. Se ha descrito que ETS1 es capaz
de promover el cambio del fenotipo quiescente de las CEs a un
fenotipo angiogénico
23
. Varios grupos de investigación han desta-
cado el papel de ETS1 en la regulación de CCL2. En este sentido,
se ha descrito que ETS1 se une a la región promotora de CCL2 en
la inflamación vascular mediada por Ang-II. La Ang-II induce la
expresión de CCL2 en CEs y CMLVs en ratones
wild-type
pero
no en
ratones knock-out
ETS1
-/-
. Nosotros hemos observado cómo
el FT potencia la unión de ETS1 en la región promotora del gen
CCL2 en CEs microvasculares induciendo su expresión y secre-
ción
14
. La secreción de CCL2 por parte de estas células induce el
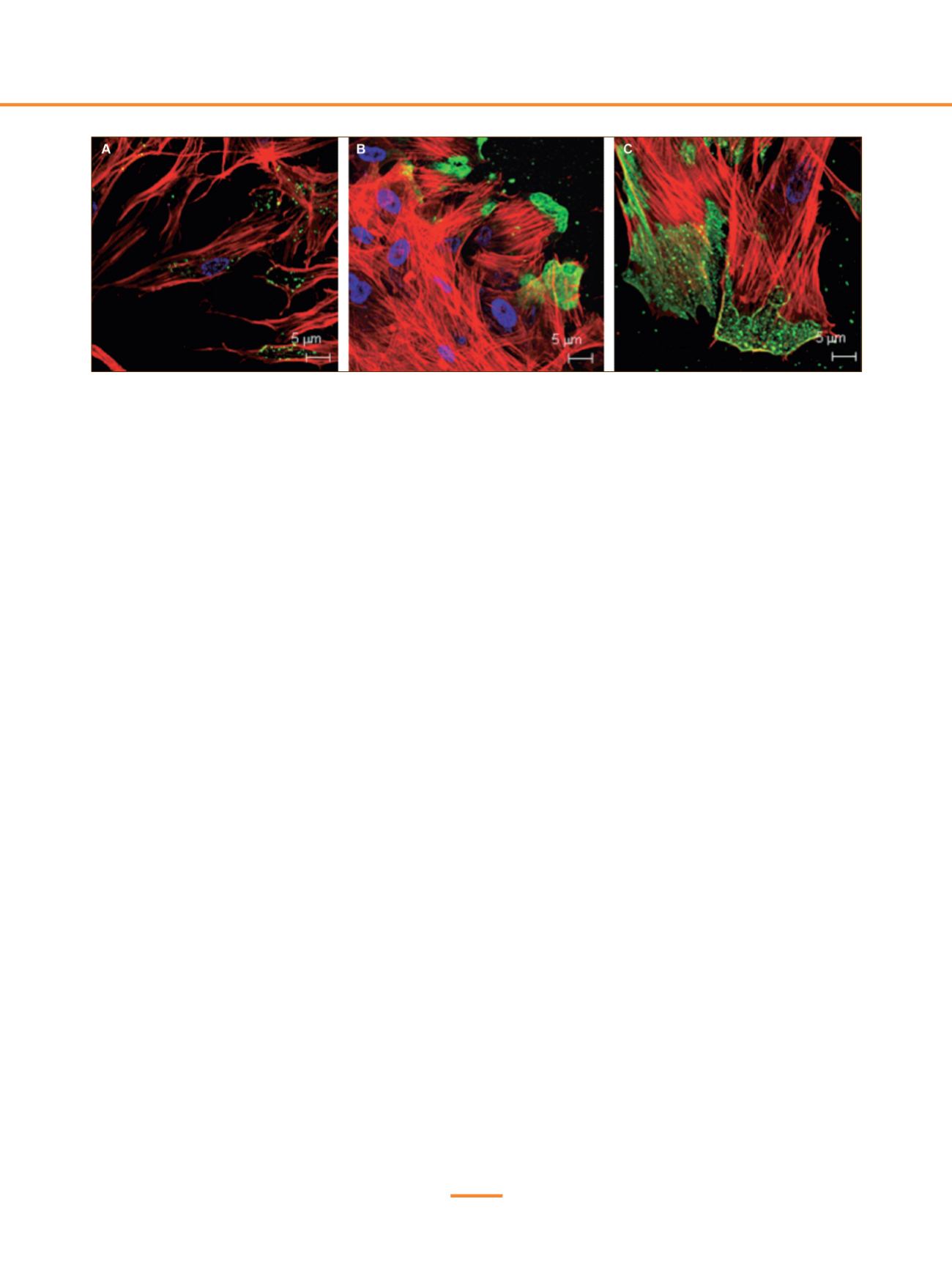
Figura 1.
Localización celular del FT en CMLVs quiescentes y migratorias.
Las células se tiñeron con un anticuerpo anti-FT (verde), un anticuerpo anti-faloidina (rojo), que se une a los filamentos de actina del citoesqueleto y
Hoechst 33342 (azul), que marca los núcleos. A) CMLVs quiescentes. B y C) CMLVs en migración. El FT se localiza en el frente de migración. Adaptado
de Peña, E. et al. 2012.
.



















